Física y química Tema 4. Cambios en la materia
. Modelos atómicos
Demócrito: fue un filósofo de la antigua grecia. Fue la primera persona que explicó que la materia estaba formada por átomos. Su idea no se volvió a considerar hasta el siglo XIX (19).
Dalton: Siglo XIX. Retomó las ideas de Demócrito. Creía que el átomo era una esfera compacta, indivisible e indestructible.
Thomson. Siglo XIX. Descubrió los electrones (partícula subatómica con carga negativa). El explica que el átomo es como un pudding de pasas, las pasas son los electrones que están incrustados en el pudding que es la masa positiva.
Rutherford. Siglo XX. Descubrió que en el centro había una masa con carga positiva (nucleo). El decía que el átomo era como el sistema solar, el núcleo es el sol que está en el centro y los planetas los electrones que orbitan alrededor del centro. Utiliza las leyes de la física de Newton.
Bohr. Siglo XX. Es el primero en utilizar la física cuántica para explicar el átomo. Su modelo es parecido al de Rutherford. El dice que el átomo tiene un núcleo con carga positiva y alrededor giran los electrones. Cuando los electrones giran en una órbita ni ganan ni pierden energía pero si cambian de órbita SI intercambian energía (ganan o pierden).
***************************************************************************************
Los átomos: La materia está formada por partículas indivisibles llamadas átomos.
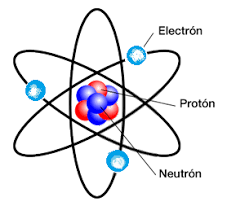
El átomo está formado por:
|
carga |
lugar |
peso |
|
|
Protones |
+ |
núcleo |
1 uma |
|
Neutrones |
Ninguna. Neutra de neutrón |
núcleo |
1 uma |
|
Electrones |
– |
corteza |
0,0005 uma |
Los átomos de un elemento químico: Son todos iguales entre sí y diferentes entre los átomos de cualquier otro elemento químico.
Un compuesto: está formados por átomos de 2 o más elementos que se combinan en una proporción fija.
Teoría de Dalton (clasificación de la materia):
-
Sustancia simple -> formada por un solo tipo de átomos.
-
Compuesto: sustancia formada por más de un tipo de átomos combinados en una proporción fija.
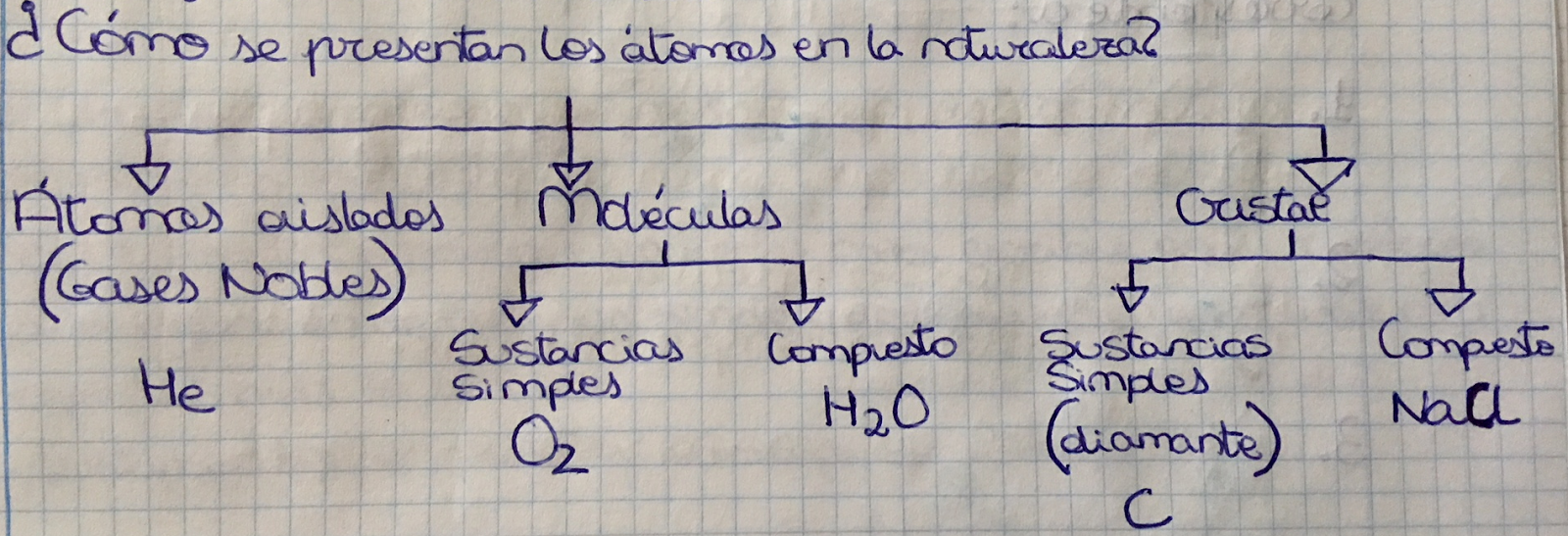
Átomos aislados: Solo aparecen aislados en la naturaleza los del grupo 18 (Helio He, Neón Ne, Argón Ar, Kriptón Kr, Xenón Xe y Radón Rn)
Moléculas: agrupaciones de varios átomos iguales o diferentes que se combinan siempre en la misma proporción.
-
Átomos iguales -> Sustancias simples moleculares
O2 -> Oxígeno
P4 -> Fósforo
-
Átomos diferentes -> Compuestos moleculares
H2O -> Agua
Cristales: Sólidos en los que se unen de manera ordenada un número muy grande de átomos.
-
Sustancias simples cristalinas. Átomos del mismo elemento. Son sólidos.
-
Compuestos cristalinos. Átomos de dos o más elementos en una proporción fija. Son sólidos.
Ejemplos:
-
cambio de estado
-
mezcla y separación de sustancias
-
cambios de temperatura
-
cambios de tamaño
Cambio químico. Si varía la naturaleza de la materia. La fórmula antes y después del cambio es diferente.
Ejemplos:
-
electrolisis
-
combustiones
3. Cambios físicos y químicos
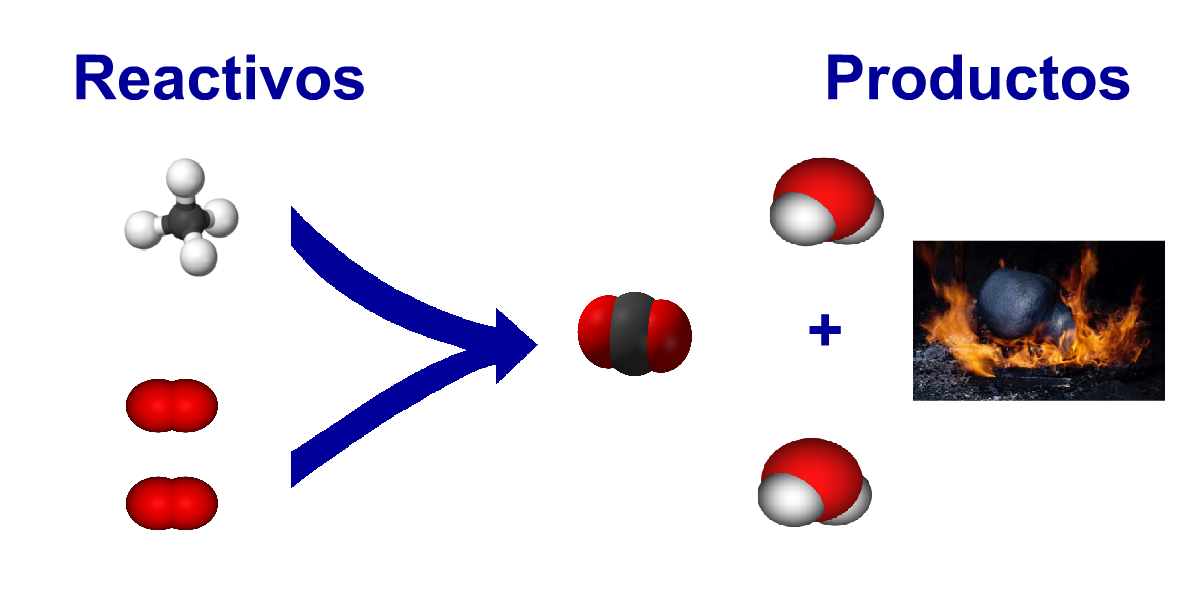
Reacción química: son los cambios químicos. Una o maś sustancias reaccionan para formar otra diferente.
H2 + O2 -> H2O
H2 + O2 -> H2 O2
¿Cómo se produce una reacción química? Teoría de las colisiones
Se supone que las partículas tienen que chocar de forma eficaz:
-
Con energía suficiente
-
Con la orientación adecuada
Si chocan de forma eficaz se rompen los enlaces antiguos y se forman otros nuevos.
Factores que influyen en la velocidad de una reacción
-
La temperatura. A más temperatura más energía y si el choque es eficaz se produce la reacción química de forma rápida.
-
La concentración de reactivos. A más concentración de reactivos es más probable que se produzca la reacción.
-
La superficie de contacto. Si hay más superficie de contacto seguro que se produce antes la reacción.
-
Los catalizadores. Son sustancias que se añaden para aumentar la velocidad de la reacción.